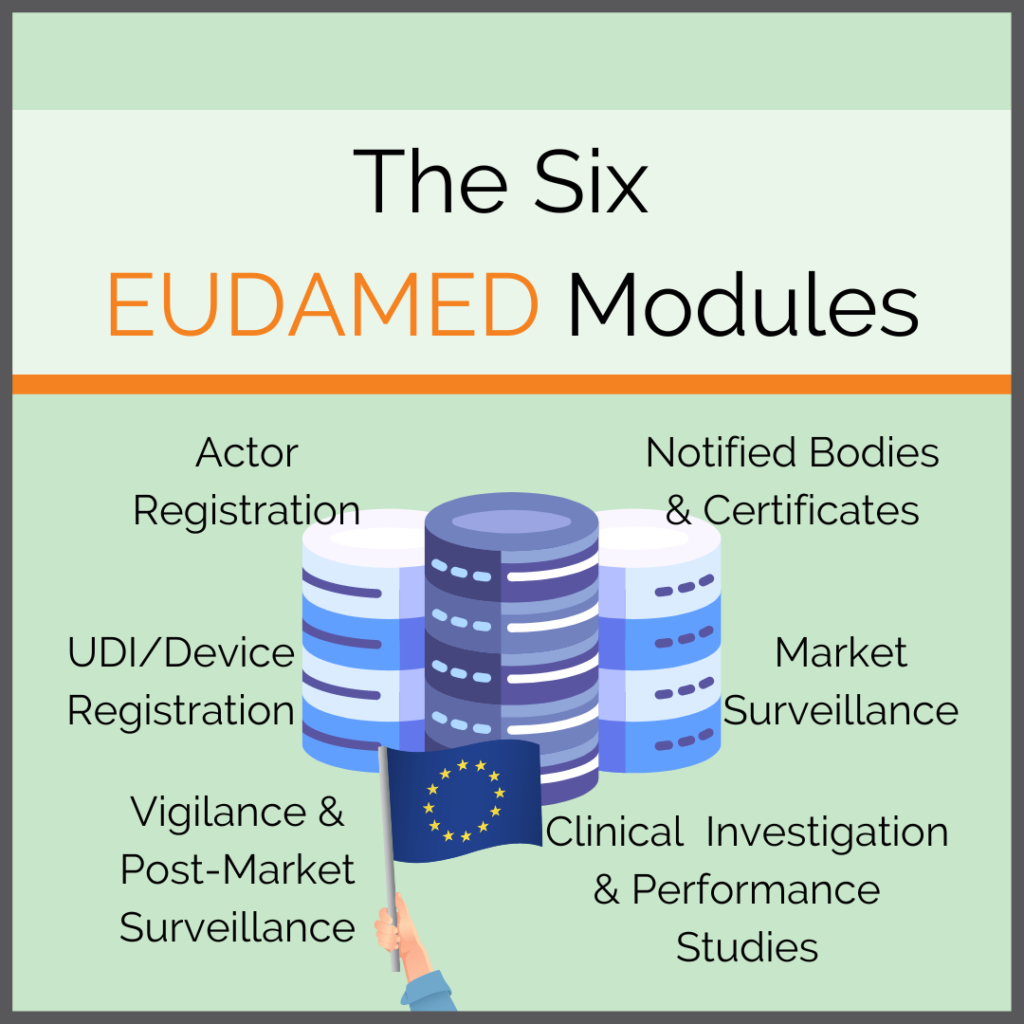
Die Europäische Kommission veröffentlicht regelmäßig Dokumente als Hilfestellung für die Benutzung der EUDAMED. Aufgrund der Komplexität der EUDAMED sowie der Vielzahl der Handhabungsdokumente ist es trotzdem wichtig sich selbst einen Überblick zu verschaffen. So erfährt man, welche Aspekte auf das eigene Unternehmen und die eigenen Produkte zutreffen. Nur so ist man ausreichend vorbereitet für die […]
Weiterlesen… from 7 Tipps für die Datenpflege in der EUDAMED